- Pathologie /
- Forschung /
- Abgeschlossene Projekte
Abgeschlossene Projekte
Es gibt zunehmend Hinweise darauf, dass aviäre Hämosporidien (Gattungen von Plasmodium, Haemoproteus und Leucocytozoon) nicht nur gutartige Kommensalen sind, sondern häufig tödliche Infektionen bei Vögeln verursachen. Die Pathogenität wird überwiegend durch Gewebsstadien dieser Parasiten bedingt, die sich in verschiedenen Zelltypen entwickeln und zu einer Blockade von Blutgefäßen und Gewebeschäden führen. Gegenwärtig gibt es kaum Kenntnisse zur Langzeitpersistenz dieser Infektionen und das Vorhandensein ruhender Parasitenstadien, über die Zielzellen replikativer Gewebestadien, zur Auswirkung von Mischinfektionen auf das Ausmaß von Gewebeschäden, sowie zur Frage, ob 18S ribosomale RNA in bestimmten Entwicklungsstadien von aviären Malaria-Parasiten unterschiedlich exprimiert sind.
In dieser Studie sollen folgende Hypothesen getestet werden: (1) In Analogie zu Malaria-Parasiten von Primaten weisen aviäre Hämosporidien auch genetisch unterschiedliche Varianten der ribosomalen 18S-RNA in Wirten (Vögeln) und Vektoren (Stechmücken oder Gnitzen) auf. (2) Rückfälle bei Vogelmalaria werden durch ruhende Gewebsstadien verursacht, die durch ausreichend empfindliche molekulare Nachweismethoden sichtbar gemacht werden können. (3) Die exoerythrozytäre Vermehrung von Vogelmalaria-Parasiten der Vögel ist auf wenige spezialisierte Wirtszelltypen in verschiedenen Geweben beschränkt und verursacht in Mehrfachinfektionen stärkere Gewebsläsionen.
Zunächst werden differentiell exprimierte 18S rRNA-Varianten durch varianten-spezifische Sonden in Vogelwirten und Arthropodenvektoren dargestellt. Diese Ergebnisse sind die Basis der nachfolgenden Projektteile. Ruhende Stadien sollen durch ein hochsensibles In-situ-Hybridisierungsverfahren in experimentell infizierten Kanarienvögeln sichtbar gemacht werden. Die Wirtszelltypen, die die Vermehrung von Parasiten in verschiedenen Geweben unterstützen, werden durch Doppelmarkierungsansätze mit Antikörpern für bestimmte Zellmarker und molekulare Sonden für Hämosporidien identifiziert. Schließlich soll die Auswirkung von Mischinfektionen mit zwei oder mehr Hämosporidienarten mittels Doppelmarkierungen untersucht werden.
Die Mehrzahl der angegebenen Forschungsfragen wurde bisher nicht angesprochen (ruhende Stadien und differenzielle Expression von rRNAs bei Vogelmalaria) oder nicht auf vergleichbar überzeugende Weise untersucht (Identifizierung von Zelltypen, die die Vermehrung von Vogelmalaria-Parasiten ermöglichen, Auswirkungen von Mischinfektionen auf die Schwere der Gewebeschäden).
Mitarbeiter:
Univ.-Prof. Dr. Herbert Weissenböck, Dipl.ECPHM, Projektleitung
Dr. Josef Harl, Postdoc
MMag. Tanja Himmel PhD, Postdoc
Kooperationspartner:
Dr. Gediminas Valkiunas, Mikas Ilgunas, PhD, Nature Research Centre, Vilnius, Litauen
Projektzeitraum: 10/2020 - 09/2023
Finanzierung:
FWF - Fonds zur Förderung der Wissenschaftlichen Forschung
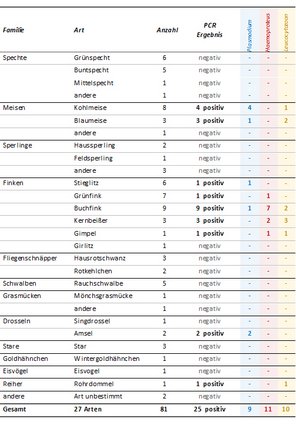
In einem aktuellen vom FWF geförderten Projekt untersuchen wir, ob Infektionen mit verschiedenen Blutparasiten (Plasmodium, Haemoproteus, Leucocytozoon) häufiger für schwere Krankheiten und Todesfälle bei verschiedenen Arten einheimischer Wildvögel verantwortlich sind als bisher vermutet. Die aktuell verfügbaren Proben könnten aufgrund der Vorselektion ein verfälschtes Bild geben, da die meisten von ihnen von Vögeln stammen, die (1) während Epidemien der tödlichen Usutu-Virusinfektion beprobt wurden, (2) einer Vogelklinik zum Zweck einer Behandlung vorgestellt wurden und (3) oder im Rahmen von Fängen bei Beringungs-Kampagnen verstorben sind.
In dieser Sammlung (bestehend aus ca. 1000 Individuen) sind bestimmte Vogelfamilien, darunter Stelzen, Lerchen, Spechte, Meisen, Sperlinge, Ammern und Finken stark unterrepräsentiert. Um diese Verzerrung teilweise aufzulösen, schlagen wir einen Citizen Science Ansatz für die Meldung und Sammlung insbesondere von Vogelkadavern der oben genannten Familien zur Bestimmung von Hämosporidien-Infektionen vor.
Wir gehen davon aus, dass die Beteiligung von Bürgern (Crowdsourcing) an der Meldung, Identifizierung und Einsendung von toten Vögeln ein wirksames Instrument ist, um eine ausreichende Anzahl erforderlicher Vogelarten für die Hämosporidienforschung zu generieren.
Ziel dieses Projekts ist es, Zugang zu Körpern toter Vögel für die wissenschaftliche Aufarbeitung zu erhalten. Die potenziell hohe Zahl von Menschen mit Interesse an Vogelbeobachtung und Naturschutz wird durch Pressemitteilungen, Web- und Social Media-basierte Informationen und in enger Zusammenarbeit mit dem Österreichischen Vogelschutzverband BirdLife dazu angeregt, tote Vögel zu melden und Tierkörper zu übersenden.
Citizen Science wurde erfolgreich in Überwachungsprojekten für verschiedene Virus-, Bakterien- und Protozoeninfektionen von Wildvögeln eingesetzt. Im Zusammenhang mit Aviären Hämosporidien / Aviärer Malaria wurde dieser Ansatz bisher nicht angewandt, obwohl wir ihn für ein leistungsfähiges Tool halten, um eine große Anzahl von Vogelkadavern für die wissenschaftliche Forschung verfügbar zu machen.
Das Projekt wird von Wissenschaftlern des Instituts für Pathologie an der Veterinärmedizinischen Universität Wien koordiniert und betreut. Dort besteht Erfahrung mit vergleichbaren Citizen Science Projekten, die zur Sammlung einer großen Anzahl von Vögeln der Familie der Drosseln (vor allem Amseln) während einer Usutu-Virus Überwachung führten.
Mitarbeiter:
Univ.-Prof. Dr. Herbert Weissenböck, Dipl.ECPHM, Projektleitung
Dr. Josef Harl, Postdoc
MMag. Tanja Himmel PhD
Kooperationspartner:
StadtWildTiere
WildeNachbarn
BirdLife
Projektzeitraum: 06/2020 - 10/2020
Finanzierung:
FWF - Fonds zur Förderung der Wissenschaftlichen Forschung
Pneumocystis spp. zählen zu den Pilzen und können in einer großen Anzahl von Säugetieren Pneumonien verursachen. Bei Mensch und Ratte wurde eine hohe Infektionsrate festgestellt, aber auch beim Schwein konnte Pneumocystis in 51% der Schweine mit Lungenentzündung und in 73% der Schweine ohne respiratorische Symptome nachgewiesen werden. Beim Menschen kann die Kolonisation der Lunge mit Pneumocystis zu verschiedenen potentiell wichtigen klinischen Effekten, wie zum Beispiel der Entstehung einer akuten Pneumonie, der Übertragung auf andere Menschen oder der Beteiligung an der Entstehung von Lungenkrankheiten führen.
Die Schweinehaltung unterscheidet sich von Haltungsbedingungen anderer Tierarten dadurch, dass verschiedene Altersgruppen gemeinsam in einem Stall gehalten werden. Dieser Faktor fördert das Auftreten von polymikrobiell bedingten Krankheiten und gerade Atemwegserkrankungen verbreiten sich sehr leicht und stellen eine der wichtigsten Krankheitsursachen dar. Daten aus Voruntersuchungen zeigten, dass Pneumocystis ein förderlicher Kofaktor polymikrobiell bedingter respiratorischer Erkrankungen sein kann. Vor allem die Infektion von jungen Schweinen kann von wirtschaftlicher Bedeutung sein, da Entwicklungsdefizite, die früh im Leben auftreten, nur schwer ausgeglichen werden können.
Derzeit ist das Genom von Pneumocystis carinii f. sp. suis (im vorliegenden Antrag als Pneumocystis suis bezeichnet) nahezu unbekannt. Durch die Sequenzierung des gesamten Pneumocystis suis-Genoms werden nicht nur dessen Struktur, sondern auch Informationen über metabolische und andere biologische Eigenschaften verfügbar. Wir planen, diese Daten in weiterer Folge mit jenen von anderen Pneumocystis-Spezies zu vergleichen. Die Charakterisierung des Genoms wird zu einem besseren Verständnis der Entstehung und Entwicklung der Pneumocystis-Pneumonie beim Schwein beitragen und die Richtung für die Entwicklung neuer Strategien die Diagnose, Behandlung und Prävention betreffend vorgeben.
Die Untersuchung von Pneumocystisjirovecii beim Menschen zeigte, dass die jeweilige Pilzkonzentration in den Lungen abhängig vom jeweiligen Pneumocystis-Genotyp, aber auch vom Vorliegen bestimmter Koinfektionen stark variieren kann. Neben der Sequenzierung des Pneumocystis suis-Genoms planen wir die Ermittlung der Heterogenität dieses Erregers. Die Analyse von Proben aus verschiedenen Betrieben eröffnet die exzellente Möglichkeit zu untersuchen, ob unterschiedliche Pneumocystis suis-Genotypen existieren. Außerdem können mögliche Assoziationen zwischen diesen Genotypen und der Pneumocystis suis-Konzentration, dem Alter der Tiere, klinischen Symptomen und bestimmten Koinfektionen sowie die Pneumocystis suis-Epidemiologie auf Herdenbasis evaluiert werden.
Mitarbeiter:
Univ.-Prof. Dr. Herbert Weissenböck
Priv.-Doz. Dr. Christiane Weissenbacher-Lang
Kooperationspartner:
Univ.-Prof. Dr. Wolfgang Sipos, Universitätsklinik für Schweine, Veterinärmedizinische Universität Wien
Prof. Dr. Liang Ma, Critical Care Medicine Department, NIH Clinical Center, Bethesda, Maryland, USA
Dr. Ousmane Cissé, Critical Care Medicine Department, NIH Clinical Center, Bethesda, Maryland, USA
Projektzeitraum: 09/2018 – 08/2021
Finanzierung:
FWF - Fonds zur Förderung der Wissenschaftlichen Forschung
Aviäre Hämosporidien der drei Gattungen Plasmodium, Haemoproteus und Leucocytozoon sind nahezu weltweit verbreitet und befallen zahlreiche Vogelarten. Während in früheren Studien der Schwerpunkt auf ökologischen, evolutionären und taxonomischen Aspekten dieser Infektionen lag, war es unser Ziel, durch diese Parasiten verursachte Krankheiten und Todesfälle bei Wildvögeln in den Vordergrund zu stellen. Krankheiten bei Vögeln werden überwiegend durch Gewebestadien der Parasiten induziert, die mit morphologischen Methoden nicht unterschieden werden können. PCR-Assays und anschließende Sequenzanalysen führten zu signifikanten Fortschritten beim molekularen Barcoding der Parasiten und identifizierten mehr als 3500 einzelne Lineages. Aufgrund häufig auftretender Mischinfektionen erlaubt es diese Technik jedoch nicht, die Identität eines spezifischen Parasiten, der für Gewebeläsionen verantwortlich ist, zuverlässig festzustellen. Daher war ein Verfahren, das es ermöglicht, Gewebestadien auf Gattungs- oder Artenebene spezifisch zu identifizieren, von hoher Wichtigkeit.
Aufbauend auf unseren Erfahrungen mit der in situ Hybridisierung und dem erfolgreichen Design einer Oligonukleotidsonde zur Markierung von Parasiten der Gattung Plasmodium generierten und testeten wir erfolgreich Sonden zur Identifizierung der Gattungen Haemoproteus und Leucocytozoon. Dies war keine einfache Aufgabe, da die Gensequenzen der ribosomalen RNA dieser Parasiten unbekannt waren und kloniert und sequenziert werden mussten. Vergleichbar mit Plasmodium-Arten, die Malaria beim Menschen verursachen, wurden in Vertretern aller drei Hämosporidien-Gattungen mehrere unterschiedliche Varianten von rRNA-Genen identifiziert. Basierend auf diesen Sequenzen konnten robuste und spezifische Sonden entworfen werden, die erfolgreich zur Identifizierung verschiedener Arten von Blut- und Gewebestadien verwendet wurden. Zusätzlich wurden mehrere speziesspezifische Sonden hergestellt. Mit Hilfe dieser Sonden konnte festgestellt werden, dass zwei in Amseln häufig vorkommende Plasmodium-Arten, Plasmodium vaughani und P. matutinum, für diese Vögel von unterschiedlicher Virulenz waren. Infektionen mit P. matutinum führten zu einer viel stärkeren und destruktiveren Vermehrung von Gewebsstadien dieser Parasiten. Während eine große Anzahl verschiedener Haemoproteus-Lineages, die bei verschiedenen Vogelarten beobachtet wurden, hauptsächlich mit geringgradiger Gewebe-Merogonie assoziiert waren, was auf ein geringes pathogenes Potenzial hinweist, waren mehrere Leucocytozoon-Lineages, die entweder bei Sperlingsvögeln sowie bei Eulen oder Greifvögeln beobachtet wurden, mit Megalomeronten-Bildung assoziiert und zeigten signifikante Gewebeläsionen. Daher erscheint es für zukünftige Studien lohnend, Leucocytozoon-Infektionen bei Wildvögeln intensiver zu untersuchen, um eine größere Anzahl von Todesfällen bisher unbekannter Ursache aufzuklären.
Das aktuelle Projekt diente als Grundlage für ein damit in Verbindung stehendes Citizen Science Projekt und ein dreijähriges Folgeprojekt mit den Zielen, nach den bislang unbekannten Gewebslokalisationen von ruhenden Stadien (dormant stages) der Vogel-Hämosporidiosen zu suchen, experimentell zu überprüfen, ob sich unterschiedliche Varianten von rRNA im Vektor und im Wirt feststellen lassen, und zu untersuchen, ob sich traditionelle Konzepte zur zellulären Lokalisierung von Meronten unter Verwendung moderner Methoden zur Zellidentifikation als richtig erweisen.
Mitarbeiter:
Univ.-Prof. Dr. Herbert Weissenböck, Dipl.ECPHM, Projektleitung
Dr. Josef Harl, Postdoc
MMag. Tanja Himmel PhD
Kooperationspartner:
Dr. Gediminas Valkiunas, Nature Research Centre, Vilnius, Litauen
A.o. Prof. Dr. Alexandra Scope, Interne Medizin Kleintiere, Vetmed.Uni.Wien
Univ.-Prof. Dr. Leonida Fusani, KLIVV, Vetmed.Uni.Wien
Projektzeitraum: 03/2017 - 09/2020
Finanzierung:
FWF - Fonds zur Förderung der Wissenschaftlichen Forschung
Publikationen:
Haemosporidioses in wild Eurasian blackbirds (Turdus merula) and song thrushes (T. philomelos): an in situ hybridization study with emphasis on exo-erythrocytic parasite burden.
Tanja Himmel, Josef Harl, Simone Pfanner, Nora Nedorost, Norbert Nowotny, Herbert Weissenböck
Malaria Journal 2020; 19:69
Link: https://malariajournal.biomedcentral.com/articles/10.1186/s12936-020-3147-6
Molecular probes for the identification of avian Haemoproteus and Leucocytozoon parasites in tissue sections by chromogenic in situ hybridization
Tanja Himmel, Josef Harl, Anna Kübber‑Heiss, Cornelia Konicek, Nuhacet Fernández, Carles Juan‑Sallés,
Mikas Ilgūnas, Gediminas Valkiūnas, Herbert Weissenböck
Parasites & Vectors2019; 12:282
Link: https://parasitesandvectors.biomedcentral.com/articles/10.1186/s13071-019-3536-2
The nuclear 18S ribosomal DNAs of avian haemosporidian parasites
Josef Harl, Tanja Himmel, Gediminas Valkiūnas, Herbert Weissenböck Malaria Journal 2019; 18:305
Link: https://malariajournal.biomedcentral.com/articles/10.1186/s12936-019-2940-6
Geographic and host distribution of haemosporidian parasite lineages from birds of the family Turdidae.
Josef Harl, Tanja Himmel, Gediminas Valkiūnas, Mikas Ilgūnas, Támas Bakonyi, Herbert Weissenböck
Malaria Journal 2020; 19:335
Link: https://malariajournal.biomedcentral.com/track/pdf/10.1186/s12936-020-03408-0
Pneumocystis carinii ist bei immunsupprimierten Patienten von großer Bedeutung, da diese infolge einer massiven Proliferation des Pilzes lebensbedrohliche Pneumonien entwickeln können. Das Vorkommen dieses Erregers ist bei vielen Säugetierspezies beschrieben, das verursachte Krankheitsbild variiert jedoch.
Ziel des Projektes ist die Abklärung der Rolle von Pneumocystis carinii bei Schweinen mit multifaktioriell bedingten respiratorischen Krankheiten sowie die Abschätzung einer möglichen wirtschaftlichen Bedeutung dieses Pilzes. Folgeprojekte, die sich mit der genetischen Heterogenität von Pneumocystis carinii f. sp. suis beschäftigen werden, sind in Planung.
Beteiligte Mitarbeiter:
Priv.-Doz. Dr. Christiane Weissenbacher-Lang
Univ.-Prof. Dr. Herbert Weissenböck, Dipl.ECPHM
Nora Nedorost, MSc
Kooperationspartner:
Mag. Christian Knecht, Universitätsklinik für Schweine
Univ. Prof. Dr. Wolfgang Sipos, Universitätsklinik für Schweine
Dr. Branislav Kureljušić, Department of Pathology, Institute of Veterinary Medicine of Serbia, Belgrade, Serbia
Dr. Mathias Huber, Traunkreis VetClinic
Dr. Thomas Voglmayr, Traunkreis VetClinic
Finanzierung:
Profillinien (VetEasy - Intranet, nur am Campus oder über ASA-Server)
Verein der Freunde und Förderer der Schweinemedizin
Mittels unterschiedlicher molekularer und histochemischer Techniken werden Zellzyklusstudien an Nervenzellen in nativen und formalin-fixierten Gehirnen von verstorbenen Katzen durchgeführt.
Studien an Nervenzellkulturen und slice cultures von Hippocampus und anderen Gehirnarealen sollen weitere Einblicke bezüglich der Teilungsfähigkeit von adulten Nervenzellen erbringen und breitere Ansätze zur Erforschung des Nervenzellstoffwechsels ermöglichen.
Beteiligte Mitarbeiter:
Dr. Angelika URL
Dr. Barbara Rebel-Bauder
Dissertanten, Diplomanden
Mykoplasmen werden vielfach aus dem Respirationstrakt von Tieren mit Atemwegserkrankungen isoliert, oft bleibt deren pathogenetische Bedeutung jedoch unklar.
Im Rahmen dieses Projekts soll mit Hilfe der Immunhistochemie unter Verwendung von Antikörpern gegen zahlreiche Mykoplasmenarten geklärt werden, ob sie in pneumonischen Läsionen stark konzentriert sind und somit eine ursächliche Rolle im jeweiligen Krankheitsgeschehen spielen könnten. Zurzeit werden Pneumonien bei Schwein, Hund, Katze und unterschiedlichen Vogelarten untersucht.
Beteiligte Mitarbeiter:
Univ.-Prof. Dr.Herbert Weissenböck, Dipl.ECPHM
Dr. Barbara Richter, Dipl.ECVP
Ingrid Friedl
Dissertanten, Diplomanden
Kooperationspartner:
Institut für Bakteriologie und Hygiene
Geldgeber:
Hochschuljubiläumsstiftung der Stadt Wien
Mit Hilfe "maßgeschneiderter" Oligonukleotid-Gensonden und der chromogenen in- situ Hybridisierung werden neue Nachweismöglichkeiten einer Reihe von veterinärmedizinisch bedeutsamen Protozoen und anderer einzelliger Pathogene entwickelt.
Die Gensonden werden rigorosen Tests auf Spezifiät unterzogen und stellen neue Werkzeuge in der Diagnostik und Pathogeneseforschung dar.
Beteiligte Mitarbeiter:
Univ.-Prof. Dr.Herbert Weissenböck, Dipl.ECPHM
Dr. Barbara Richter, Dipl.ECVP
Mag. Nora Dinhopl
Karin Fragner
Geldgeber:
FWF - Fonds zur Förderung der Wissenschaftlichen Forschung